这个文章很有意思,把业内的东西拿到了台面上了,算是“已知公论”的证明。
早期,大家做蛋白降解领域项目调研的时候,需要预判断靶蛋白能否被降解,以及降解的效率等问题。
通常,三元复合物模型建好后,通过进一步建立完整的E3复合物降解靶蛋白模型,分析靶蛋白正面的赖氨酸分布数量,有很多,就差不多可以运用降解这个技术。如果赖氨酸都在背面,那这个靶点或许就不适合或者 PROTAC 分子设计的就不大对。
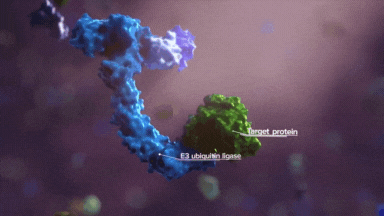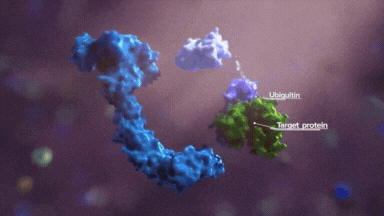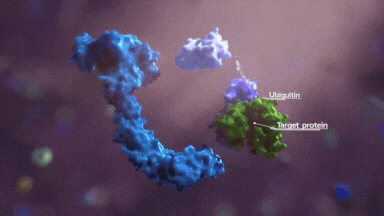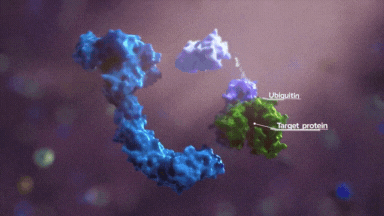
接下来就是判断就是赖氨酸的可及性,一是合适的位置有没有赖氨酸,二是赖氨酸的指向性,三是反应活性。
晶体结构解析中可以发现座子骨架上的部分区域是没法被解析的,意味着这部分连接处是无序的,赋予复合物一定程度上的柔性,导致泛素化位点会是一个区域,距离差不多,大概周边有的话,就初步默认这个靶点通过 degrader 可以很好的被泛素化和降解。

这些成为了以前对项目的基本判断,但是,事实真的是这样子么?
Science adv. 发表了 Alessio Ciulli 团队的最新文章:降解剂靶向蛋白质泛素化的机制。
通用模型如下,非常的形象。
首先,以泛素化可及性进行区分,靶蛋白上存在 Light 一面和 Dark 一面,light 面赖氨酸具有被高泛素化的能力。

其次,就是如果某些合适的赖氨酸处于最佳的位置,那么具有优先反应性,再就是临近的赖氨酸,这些共同构成了泛素化区域。
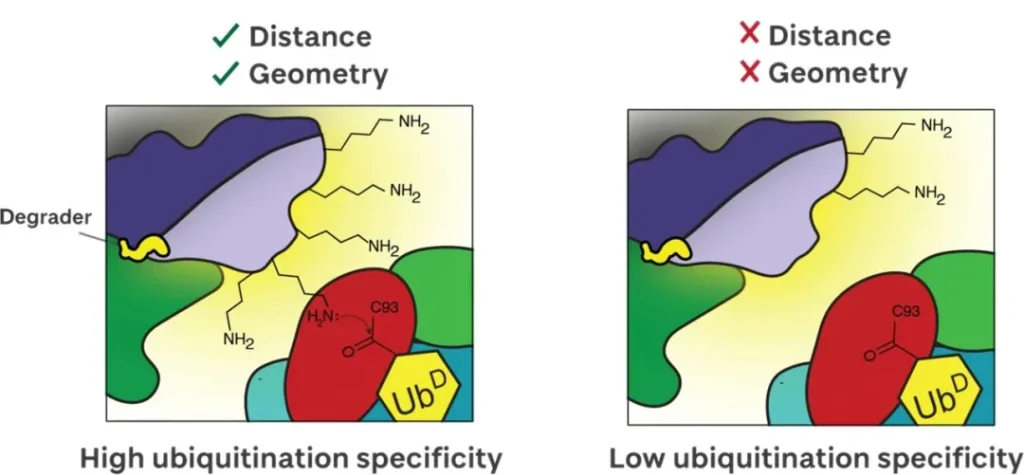
大家私下里确实都是这么说的,也是这么干的,只是没有进行完整的验证。
背景知识
E3 连接酶 CRL2VHL 包含 5 个亚基,receptor VHL、adaptor EloC 和 EloB、scaffold Cul2 以及 Rbx1。
通过 PROTAC 可以将新的底物招募到 VHL 上,从而人为诱导特定靶蛋白的泛素化和降解。
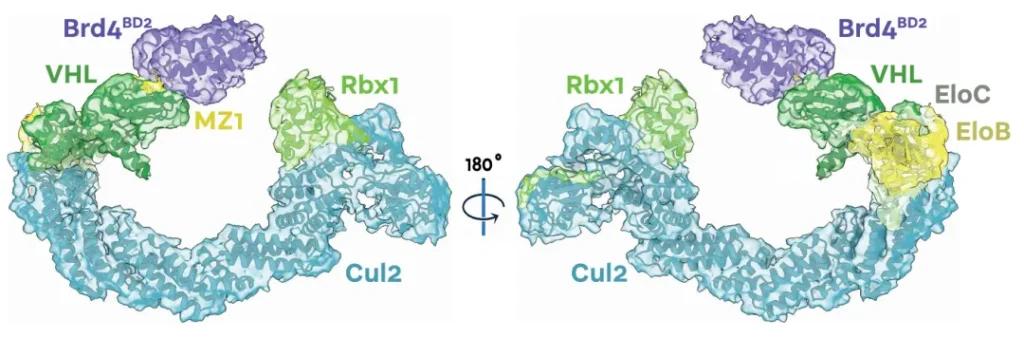
这个过程中,还有一个重要的修饰过程:Neddylation。NEDD8 修饰会引发 Cullin-RING 复合体的构象重排,并促进了 E2 泛素结合酶的结合,从而推动泛素化过程的进行。
其中涉及到 NEDD8 E1激活酶 APPBP1-UBA3、E2偶联酶 UBE2M 与 E3连接酶 Rbx1 一起作用。随后,Cul2 C端 WHB 结构域的 K689 被 NEDD8 共价修饰。
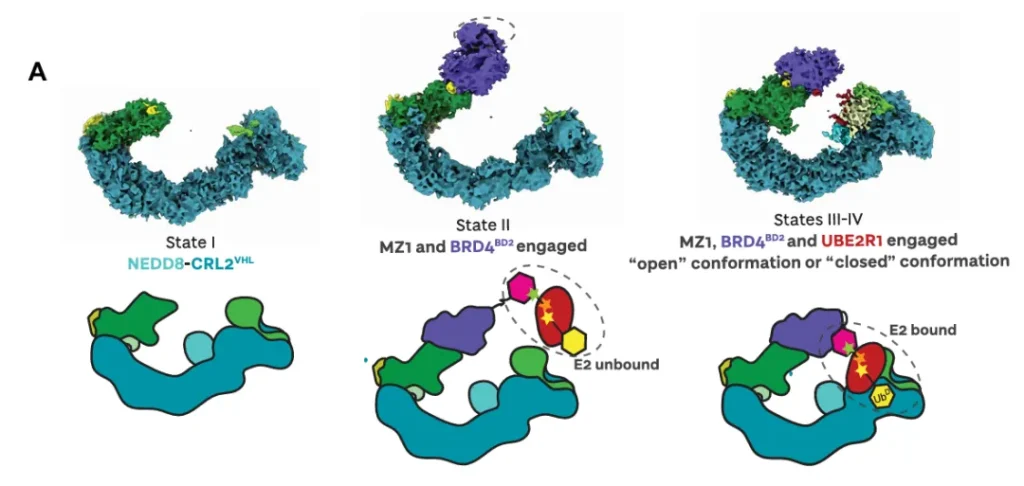
在此基础上,Ciullin 团队重建了完整的复合物结构:(NEDD8)-CRL2VHL-MZ1-Brd4BD2-Ub(G76S, K48C)-UBE2R1(C93K, S138C, C191S, C223S)-Ub。
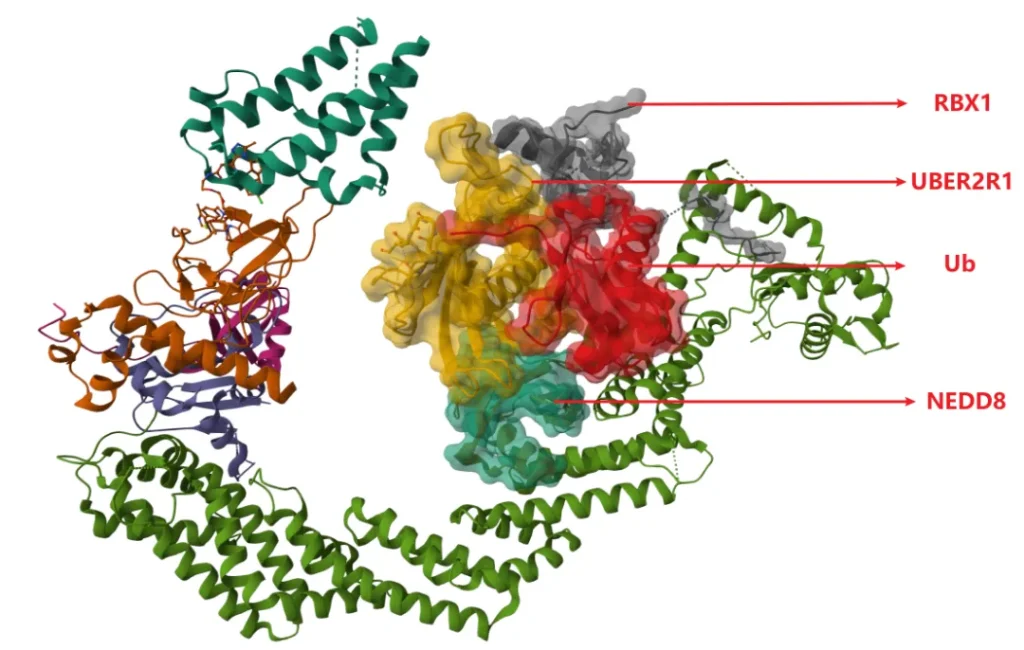
泛素化位点
基于体外的泛素化试验和质谱法,确定了 Brd4BD2 上的 8 个泛素化位点(K333、K346、K349、K355、K362、K368、K445 和 K456)。
这些赖氨酸分布在面向 Rbx1 的一面,以及非结构化 N 端尾部。其中,K456 可能是 MZ1 结合的 Brd4 BD2 机制中最优先泛素化的残基之一。
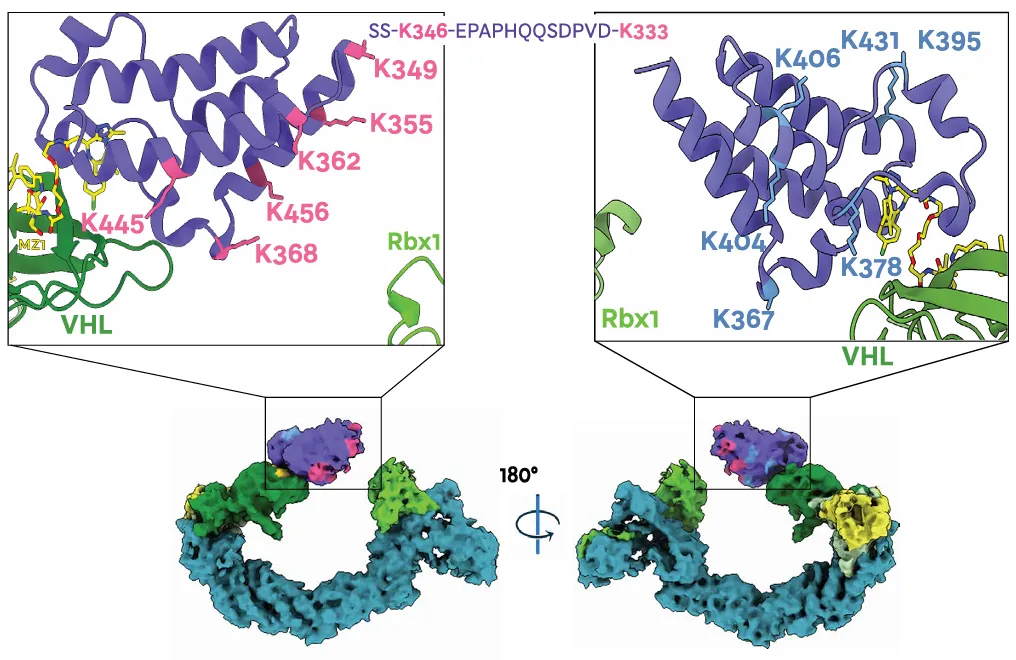
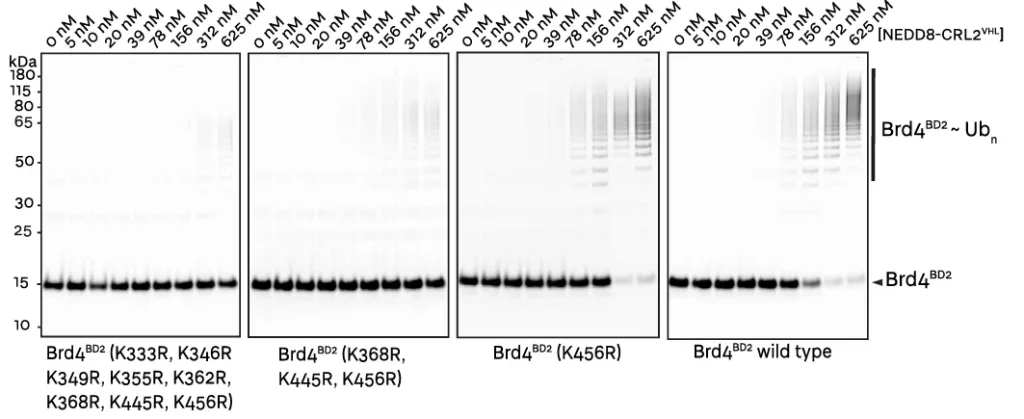
从电镜结构看,靠近 E2 活性位点半胱氨酸有三个赖氨酸 (K368、K445 和 K456) ,它们可能最为重要,为泛素化区域。
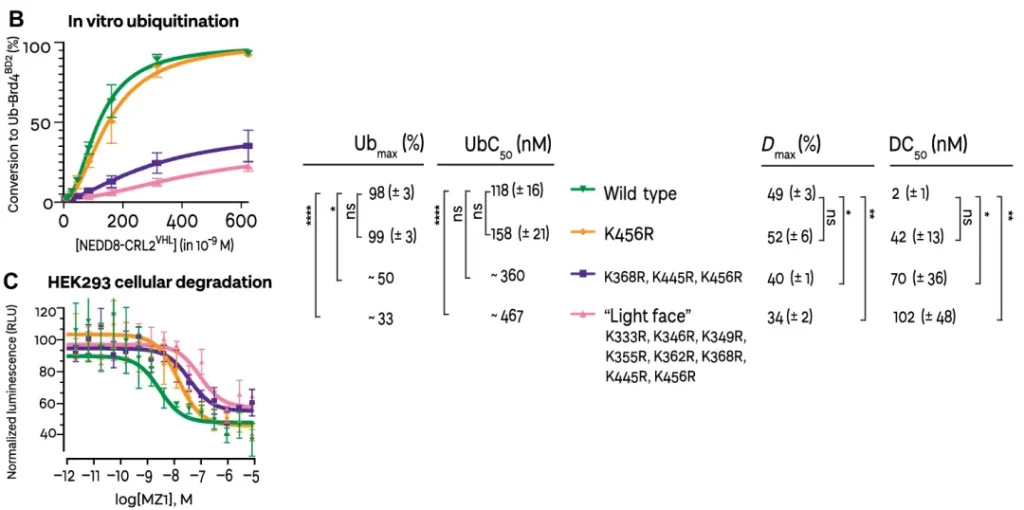
将这三个氨基酸全部突变(K2R),可以发现蛋白的泛素化能力被严重的削弱,只能看到一些模糊的条带,几乎和将 light 一面的所有赖氨酸都突变得到的突变体相似。
但是,单个突变体 K456R 与野生型具有相当的泛素化和降解能力,可能是由于 VHL-MZ1-Brd4 BD2 的寿命较长,再加上 CRL 系统的灵活性,可以缓冲该受体 Lys 456 的丢失,并允许继续捕获其他赖氨酸。
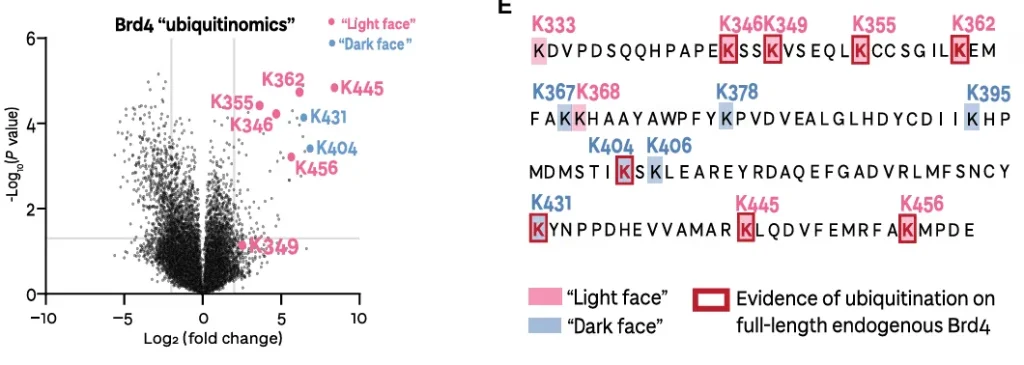
细胞内泛素化组学实验结果大体类似,Brd4 BD2 light 一面上 8 个赖氨酸残基中的 6 个在细胞中被泛素化,包括来自特定泛素化区域的 K445 和 K456,和前面一致,但 dark 一面也检测出了一些。
对于给定的 E3 连接酶,改变三元复合物中的其他两个成分中的任何一个都可能导致目标蛋白相对于 E2~Ub 的方向非常不同,导致泛素化程度出现差异化。怎么运用到实际的药物开发还是见仁见智。
【参考文献】
Mechanism of degrader-targeted protein ubiquitinability
